Инженерами АО «ЦИФРА» в составе научной группы специалистов ИММиТ СПбПУ разработан подход к проектированию эндопротеза из градиентного материала с требуемыми механическими характеристиками, на основе данных численного моделирования ячеистых структур.
Человеческие тела уникальны: генетический код, размеры органов, структура костей – всё в нашем организме индивидуально. Тем не менее, современное здравоохранение в значительной степени основано на подходе «один размер подходит всем». Однако, с совершенствованием технологий в области медицины, все большее распространение получат персонализированные методики в здравоохранении. В будущем диагностика, лечение и принятие клинических решений будут основываться на персональных данных пациента и математическом моделировании.
Тотальное эндопротезирование тазобедренного сустава
Тотальное эндопротезирование тазобедренного сустава (ТЭТС) – это замена элементов сустава эндопротезом. Целью эндопротезирования является возвращение привычного образа жизни пациента: восстановление функции сустава, восстановления мышечной силы и исчезновения болевого синдрома. Несмотря на то, что ТЭТС является одной из наиболее клинически успешных операций, с удовлетворительными клиническими результатами, 10-20% операций подвергается ревизионной хирургии.
Причины, приводящие к ревизионной хирургии, вызваны перераспределением нагрузки на костную ткань при эндопротезировании, которое возникает из-за различия жесткости протеза и кости. При производстве эндопротезов широко применяется титановый сплав, который имеет хорошую биосовместимость, обладает высокой износостойкостью и коррозионной стойкостью, но изготовленные из него эндопротезы являются более жесткими по сравнению с бедренной костью.
Стремление уменьшить количество случаев ревизионной хирургии после ТЭТС стимулирует интерес к поиску новых материалов и оптимальной топологии бедренного имплантата.
Персонализация здравоохранения будущего
Благодаря компьютерному моделированию пациенты в будущем получат доступ к протезам, которые в полной мере отвечают всем индивидуальным требованиям, а также уменьшают вероятность постоперационного вмешательства, затраты на медицинские услуги и улучшают качество жизни.
Использование компьютерного моделирование позволит врачам, производителям медицинских изделий и инженерам лучше понять, как протез будет себя вести в процессе эксплуатации даже до того, как он будет изготовлен. Компьютерное моделирование может быть использовано как для предоперационного планирования, так и для клинических исследований протезов перед их имплантацией. А вместо плана лечения, основанного на клинических испытаниях ограниченного круга пациентов, инструменты компьютерного моделирования позволят врачам разработать сотни, даже тысячи вариантов лечения, моделируя их на цифровых двойниках пациентов.
Для врачей преимущество предоперационного планирования состоит в том, что оно дает информацию о лечении конкретного пациента. Пациенты, в свою очередь, получают персонализированный подход, что снижает риск ревизионной хирургии и сокращает сроки реабилитации.
Применение аддитивных технологий
Для развития персонализированного здравоохранения одну из ключевых ролей играет возможность применения инновационных материалов и производственных технологий. В настоящее время все большую популярность набирают аддитивные технологии, позволяющие создавать материалы с переменными в пространстве механическими свойствами, за счет своей градиентной плотности. Подобные материалы представляют собой множество ячеистых структур, имеющих различные параметры и топологию, управляя которыми можно создавать конструкции с заданными механическими характеристиками. Использование таких материалов позволит создать персонализированные эндопротезы, механические свойства которых приближены к механическим свойствам бедренной кости, а пористая структура, в свою очередь, способствует врастанию живой ткани вглубь протеза.
Для того, чтобы спроектировать эндопротез, с механическими свойствами, приближенными к механическим свойствам кости, необходимо определить варианты топологий ячеистых структур, которые соответствуют по механическим свойствам бедренной кости человека. Разработанный вариант эндопротеза должен отвечать требованиям нормативных документов по испытанию готовых эндопротезов, а также выдерживать все типы нагрузок, возникающих в результате различных видов активности человека.
Определить топологию ячеистых структур материала, а также рассчитать эндопротез на прочность возможно с помощью инструментов численного моделирования ANSYS. Инженерами АО «ЦИФРА» в составе научной группы специалистов ИММиТ СПбПУ разработан подход к моделированию градиентного материала с требуемыми механическими характеристиками. На основе полученных данных спроектирован эндопротез с механическими свойствами, приближенными к механическим свойствам кости и определено, как его топология влияет на НДС кости при наиболее частых видах активности человека.
Моделирование механического поведения ячеистого материала
Параметры упруго-пластической модели материала для моделирования механических свойств ячеистых структур получены на основании обработки экспериментальных данных по растяжению образцов круглого сечения из титанового сплава ВТ6, изготовленных селективным лазерным плавлением с последующей термической обработкой.
На основе имеющихся экспериментальных данных по сжатию образцов из градиентного материала выполнена валидация математических моделей образцов. Рассматриваются эксперименты для образцов из градиентного материала, состоящего из одинаковых ячеистых структур в пределах одного образца.
Важно отметить, что деформирование образцов из градиентного материала зависит от плотности конфигурации. Деформирование образцов из градиентного материала более плотной структуры при сжатии подобно образцам сплошного сечения и графически выражается диаграммой деформирования упругопластического материала с упрочнением.
На рисунке ниже представлено совпадение результатов эксперимента и моделирования в виде диаграммы деформирования для сжимаемого образца из ячеистых структур при толщине прутка 0,8 мм.
С уменьшением плотности конфигурации деформирование начинает характеризоваться упругим поведением на начальной стадии и последующим хрупким разрушением, которое проиллюстрировано на последующих рисунках и графике для толщины прутка 0,65 мм.
 |
-%D1%81.jpg) |
Моделирование хрупкого разрушения и образец после испытания
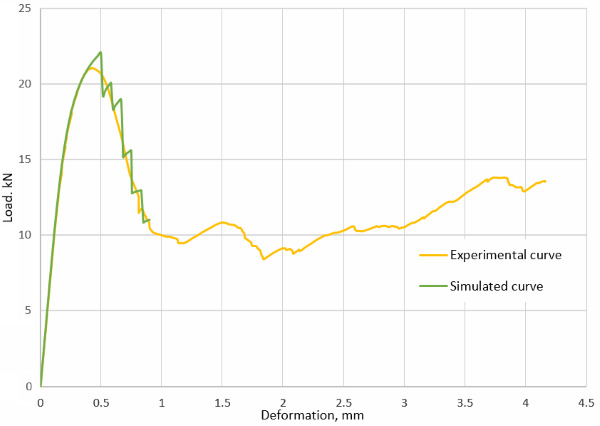
Зависимость усилия от перемещения для образца из ячеистых структур при толщине прутка 0,65 мм
Топология ячеистых структур
 Для того, чтобы спроектировать эндопротез с механическими свойствами, соответствующими бедренной кости человека, необходимо определить топологию ячеистых структур, составляющих градиентный материал. В бедренной кости человека выделяется два характерных участка, имеющих различную структуру, а, следовательно, и различные механические свойства: кортикальная (компактная) и трабекулярная (губчатая) кость. Для исследования авторами выбрано шесть вариантов топологий ячеистых структур с различным коэффициентом объемного заполнения. Диапазон изменения толщин прутков ячеистой структуры ограничен технологическими возможностями аддитивного производства.
Для того, чтобы спроектировать эндопротез с механическими свойствами, соответствующими бедренной кости человека, необходимо определить топологию ячеистых структур, составляющих градиентный материал. В бедренной кости человека выделяется два характерных участка, имеющих различную структуру, а, следовательно, и различные механические свойства: кортикальная (компактная) и трабекулярная (губчатая) кость. Для исследования авторами выбрано шесть вариантов топологий ячеистых структур с различным коэффициентом объемного заполнения. Диапазон изменения толщин прутков ячеистой структуры ограничен технологическими возможностями аддитивного производства.
Отбор ячеистых структур проведен по следующим параметрам: модуль упругости, размер пор, предел прочности. Эффективные механические свойства ячеистых структур определялись с помощью численного моделирования эксперимента на сжатие. Исследуется широкий диапазон кривой нагружения в упругой и пластической зонах, вплоть до достижения предела прочности ячеистой структуры.
Размер пор для кортикальной части кости соответствует диапазону 0,4-0,8 мкм, для трабекулярной – 0,8-1,2 мкм. Крупные поры (0,8-1,2 мкм) выполняют в протезе функцию дренажа (обеспечивают подачу органического вещества вглубь эндопротеза), малые (0,4-0,8 мкм) служат для срастания протеза с костными тканями. На данном этапе исследования отобраны варианты топологий и размера прутка, для которых размеры пор попадают в установленные условия. Размер пор в исследуемых моделях определяется размером вписанной сферы в ячеистую структуру.

Конфигурации ячеистых структур
При отборе по значению эффективного модуля упругости отобраны ячеистые структуры, эффективный модуль которых для кортикальной части кости находится в диапазоне 14-28 ГПа, а для трабекулярной части 0,1 – 4 ГПа.
Значения диапазона эффективного предела прочности для трабекулярной части соответствует диапазону 10-130 МПа, для кортикальной 100-200 МПа. На данном этапе исследования необходимо провести выбор топологий, для которых предел прочности попадает в установленные диапазоны.
Ниже приведен график, показывающий конфигурации ячеистых структур, попадающих в нужный диапазон механический свойств. Как видно из графика, ячеистых структур, отвечающих всем характеристикам кортикальной кости не найдено.

Для решения этой проблемы рассмотрены комбинации структур, с подходящим по значению эффективным модулем упругости и размером пор. На рисунке ниже приведены результаты расчетов, позволяющий определить комбинации ячеистых структур, с механическими характеристиками, соответствующими механическим характеристикам кортикальной кости.

Расчет прочности эндопротеза
Из отобранных ячеистых структур и их конфигураций спроектирована модель нового эндопротеза. Расположение отобранных ячеистых структур в нем зависит от того, с какой частью кости взаимодействует эндопротез: с кортикальной или трабекулярной.
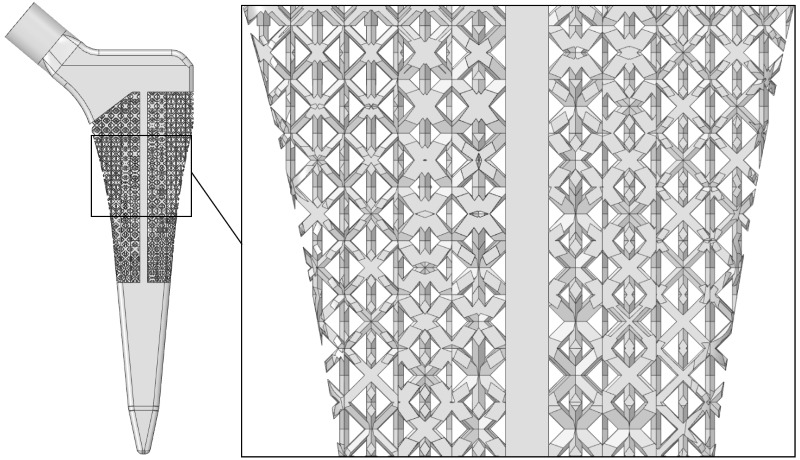
Модель эндопротеза из материала с градиентной плотностью
С помощью метода конечных элементов, реализованного в программной системе ANSYSMechanical, проведен анализ влияния топологии эндопротеза на напряженно-деформированное состояние кости при различных видах активности человека, таких как ходьба, вертикальное положение стоя, подъем в вертикальное положение, подъем по лестнице, бег. Исследование также выполнено для кости без протеза, кости со сплошным протезом и кости с протезом из градиентного материала с целью дальнейшего сравнительного анализа.
При нагружении системы «кость-протез» влияния топологии протеза на общее напряженное состояние кости не наблюдается, однако, в местах сочленения протеза из сплошного материала и поверхности кости происходит локальное уменьшение напряжений в верхней части кортикальной кости. Такая реакция возникает, когда из-за своей высокой жесткости протез воспринимает на себя основную нагрузку и не передает ее на кортикальную часть кости, уменьшая в ней. Это явление носит название "stress shielding" и является нежелательным. Согласно закону Вольффа, изменение функциональной нагрузки на кость вызывает её адаптивное ремоделирование, которое в случае уменьшения действующей нагрузки приводит к ослаблению и дальнейшему разрушению костной ткани. Из результатов расчета видно, что при использовании протеза из градиентного материала напряжения, возникающие в кости, выше, чем в случае сплошного протеза, и не превышают напряжения в кости без протеза. Таким образом, снижена вероятность возникновения явления "stress shielding", а прочность кости обеспечивается.
На рисунке представлены поля эквивалентных напряжений (МПа) для верхней части кортикальной кости без протеза (A), кости со сплошным протезом (B) и кости с протезом из градиентного материала (C) при действии комбинированной нагрузки.
 |
 |
Поля эквивалентных напряжений (МПа) для случая максимального нагружения
В результате проведения серии расчетов определено, что протезы, изготовленные из материала с градиентной плотностью, имеют меньшую жесткость, чем протезы из сплошного материала. При совместной работе системы «протез – кость» перемещения, возникающие в системе с протезом из материала с градиентной плотностью, ближе к перемещениям, возникающим в кости без протеза.
Напряжения, возникающие в протезе из градиентного материала ниже предела текучести для ВТ6. Коэффициент запаса прочности для максимального случая нагружения составляет 2. Следовательно, прочность ячеистой структуры протеза, изготовленного из градиентного материала, обеспечена при всех рассмотренных видах активности.
Заключение
В рамках выполненной работы выработан подход к численному моделированию механических свойств градиентных материалов. Спроектирована конструкция из градиентного материала: эндопротез бедренной кости человека. В результате численного моделирования определено, что протез из градиентного материала способен выдерживать нагрузки, возникающие в результате видов активности, присущих стандартной жизнедеятельности человека. Также определено, что протез из градиентного материала имеет меньшую жесткость, по сравнению с протезом из сплошного материала, что позволяет уменьшить вероятность асептического расшатывания и предотвратить возможность ревизионной хирургии.

.png)





